- Strona główna
- O nas
- Aktualności
- Klub 30
- O nas
- Aktualności
- Warsztaty z wykorzystania AI w pracy naukowo-klinicznej endokrynologa oraz kompleksowego podejścia do leczenia choroby otyłościowej.
- IX Naukowy Dzień Doktoranta
- Serdecznie dziękujemy za wsparcie
- KLUB 30 – warsztaty z (auto)prezentacji w dziedzinie medycyny
- KLUB 30 – warsztaty z przygotowania publikacji naukowych z zakresu medycyny (Proper Medical Writing)
- Wsparcie dla Agatki
- Akromegalia – optymalizacja leczenia
- Wsparcie leczenia córeczki naszej koleżanki.
- Zarząd
- Regulamin
- Kontakt
- Archiwum
- Formularz zgłoszeniowy
- Nauka i edukacja
- Składka
- Kontakt
 Polskie Towarzystwo
Polskie Towarzystwo
Endokrynologiczne
Wykorzystanie nieinwazyjnych wskaźników do badania przesiewowego populacji PCOS w kierunku chorób wątroby – badanie jednoośrodkowe
25.03.2025
Maciej Migacz, Dagmara Pluta, Kamil Barański, Bartosz Krajewski, Paweł Madej, Michał Holecki
Streszczenie: Wstęp: Badania wykazują związek pomiędzy zespołem policystycznych jajników (PCOS), a zwiększonym występowaniem stłuszczeniowej choroby wątroby związanej z zaburzeniami metabolicznymi (MASLD) w tej grupie chorych. Wciąż poszukuje się narzędzi diagnostycznych mogących prowadzić screening odpowiednich grup pacjentów z PCOS w kierunku schorzeń wątroby. Materiały i Metody: W naszym badaniu wzięły udział 242 pacjentki z PCOS rozpoznanym na podstawie kryteriów rotterdamskich, które podzieliliśmy wg fenotypów. Wykorzystując kalkulatory FIB-4 i BAAT przeprowadziliśmy screening w kierunku chorób wątroby w poszczególnych grupach pacjentek. Dodatkowo porównano wyniki pomiarów antropometrycznych, stężenia androgenów oraz wskaźnik insulinooporności (HOMA-IR) w każdej z grup. Wyniki: Wartości wskaźników FIB-4 i BAAT w tym badaniu są małe bez względu na fenotyp. Znamiennie istotną różnicę w zakresie FIB-4 odnotowano jedynie pomiędzy fenotypem A i B (p=0.01). Mediana wskaźnika FIB-4 wśród pacjentów z fenotypem B wynosiła Me: -0,51; IQR: 0,22. Mediana wskaźnika FIB-4 wśród pacjentów z fenotypem A wynosiła Me: -0,41; IQR: 0,18. Grupy pacjentek z PCOS podzielone wg fenotypów na podstawie wskaźnika BAAT są podobne, różnica ta okazała się statystycznie nieznamienna (p=0.3). Najniższe poziomy insuliny odnotowano w fenotypie C i istotnie różniły się one od poziomów insuliny w fenotypie B. Wielokrotne porównania poziomów glukozy i HOMA-IR nie różniły się istotnie. Wnioski: Prawdopodobieństwo włóknienia wątroby u badanych pacjentek z PCOS zarówno na podstawie wskaźnika FIB-4 jak i BAAT jest niskie, co najpewniej wynika z młodego wieku badanych. Wyższe wyniki wskaźnika FIB-4 uzyskaliśmy w grupie pacjentek z fenotypem B względem grupy z fenotypem A, a grupa z fenotypem B była podobna do grup z fenotypem C i D. Ponadto na podstawie naszych wyników wykazaliśmy niższy poziom insuliny w fenotypie C w porównaniu do grupy z fenotypem B. Wynik wskaźnika BAAT okazał się nieistotny statystycznie u badanych pacjentek z uwzględnieniem podziału na fenotyp PCOS.
Wstęp
Zespół policystycznych jajników (PCOS) jest częstym schorzeniem endokrynnym wśród kobiet w wieku reprodukcyjnym i w oparciu o kryteria rotterdamskie występuje u nich z częstością około 10% [1]. Aktualnie, podkreśla się heterogenność tej endokrynopatii i w związku z tym dzieli się PCOS na 4 fenotypy: w pierwszym stwierdza się hiperandrogenizm, oligo-/anowulację i policystyczną morfologię jajników (fenotyp A); w drugim hiperandrogenizm i oligo-/an owulację (fenotyp B); w trzecim hiperandrogenizm i policystyczną morfologię jajników (fenotyp C); w czwartym oligo-/anowulację i morfologię policystycznych jajników (fenotyp D) [2]. Wszystkie te fenotypy mogą wiązać się z różną częstością występowania powikłań metabolicznych i długością życia [2]. W dotychczas przeprowadzonych badaniach wykazano związek pomiędzy zespołem policystycznych jajników, a ryzykiem niealkoholowej stłuszczeniowej choroby wątroby - NAFLD (aktualnie stłuszczeniowa choroba wątroby związana z zaburzeniami metabolicznymi – MASLD [3]) [4]. Potwierdziły to badania, w których narzędziem służącym do oceny wątroby był fibroscan [5]. Innymi nieinwazyjnymi wskaźnikami, które mogą w przyszłości być wykorzystywane jako narzędzie przesiewowe w profilaktyce wtórnej MASLD są kalkulatory fibrosis index based on four factors (FIB-4) oraz BAAT [6,7]. Służą one do oceny ryzyka włóknienia wątroby; w skład FIB-4 wchodzi wiek, aktywność enzymów aminotransferazy alaninowej (ALT) i asparaginianowej (AST) oraz liczba płytek krwi [8]. Z kolei wskaźnik BAAT oblicza się na podstawie body mass index (BMI), wieku, aktywności ALT oraz stężenia triglicerydów (TG) [9]. Dotychczasowe badania wykazały wyższe wyniki FIB-4 i BAAT u pacjentek z PCOS [10]. Pomimo tych wszystkich informacji, w aktualnych międzynarodowych zaleceniach dotyczących oceny i leczenia PCOS, próżno szukać wytycznych odnoszących się do diagnostyki MASLD u tych pacjentek [11]. W naszym badaniu wykorzystaliśmy kalkulatory FIB-4 i BAAT celem screeningu w kierunku chorób wątroby u pacjentek cierpiących na PCOS, które podzieliliśmy wg fenotypów. Dodatkowo w badaniu zwróciliśmy uwagę na inne parametry, które mogą być przydatne w ocenie w kierunku MASLD u pacjentek z PCOS, tj pomiary antropometryczne, stężenia androgenów oraz wskaźnik insulinooporności (HOMA-IR).
Materiały i metody
W badaniu wzięły udział 242 pacjentki, w wieku 18-35 lat, hospitalizowane w Klinice Endokrynologii Ginekologicznej Uniwersyteckiego Centrum Klinicznego im. K. Gibińskiego Śląskiego Uniwersytetu Medycznego w Katowicach, u których na podstawie kryteriów rotterdamskich rozpoznano zespół policystycznych jajników, a następnie pacjentki przydzielono do odpowiedniego fenotypu zgodnie z przyjętą klasyfikacją: fenotyp A - 141 pacjentek, fenotyp B - 31 pacjentek, fenotyp C - 40 pacjentek, fenotyp D - 30 pacjentek. Rozpoznanie PCOS ustalono po wcześniejszym przeprowadzeniu wywiadu lekarskiego, badania ginekologicznego, oznaczeniu stężenia androgenów pochodzenia jajnikowego i nadnerczowego oraz wykonaniu badania ultrasonograficznego narządu rodnego przy użyciu aparatu Voluson 730 Expert. U wszystkich badanych pacjentek, rano na czczo, 12 godzin od ostatniego posiłku, zostało przeprowadzone badanie podmiotowe i przedmiotowe uwzględniające pomiar masy ciała, wzrostu, obwodu talii oraz obwodu bioder. Ponadto dokonano oceny masy ciała w oparciu o wskaźnik BMI zgodnie z kryteriami WHO. Do oznaczeń profilu lipidowego oraz glukozy zastosowano metodę kolorymetrii (analizator AU 680 z odczynnikami firmy Beckman Coulter (Brea, Kalifornia, USA)). Aktywności enzymów aminotransferazy alaninowej i asparaginianowej oraz morfologię krwi oznaczono analizatorem biochemicznym Cobas Pro (Roche, Szwajcaria). Po uzyskaniu powyższych wyników dokonano obliczeń wskaźników FIB-4 i BAAT. Oznaczenia estradiolu, folikulotropiny (FSH), lutropiny (LH), testosteronu całkowitego i wolnego, 17-OH-P, androstendionu, kortyzolu, DHEAS, globuliny wiążącej hormony płciowe (SHBG), hormonu antymüllerowskiego (AMH) i insuliny dokonano za pomocą metody immunochemicznej z użyciem mikrocząsteczek i znacznika chemiluminescencyjnego (CMIA) i odczynników wg. Abbott (Architect i2000SR; Chicago, IL, USA). Ocena insulinooporności została przeprowadzona metodą pośrednią z wykorzystaniem współczynnika HOMA-IR (HOMA-IR = stężenie w surowicy insuliny na czczo (uIU/ml) x stężenie w surowicy glukozy na czczo (mmol/l)/22,5). Insulinooporność rozpoznawano przy wartościach HOMA-IR ≥2,5. Indeks wolnych androgenów (FAI) został wyliczony ze wzoru: FAI = (testosteron całkowity/ SHBG) x 100%, za wartości prawidłowe przyjęto FAI <5%.
Analiza statystyczna
Wartości zmiennych ciągłych przedstawiono jako średnią z odchyleniem standardowym i medianę z przedziałem międzykwartylowym (kwartyl dolny i górny). Do oceny rozkładów zmiennych ciągłych wykorzystano test Shapiro-Wilka, natomiast różnicę między grupami oceniono za pomocą testu Kruskala-Wallisa (ze względu na brak rozkładu normalnego ocenianych zmiennych w poszczególnych grupach). Do oceny różnicy pomiędzy zmiennymi ciągłymi według fenotypów wykorzystano test post hoc Dunna. Do porównania częstości występowania cechy w grupach/podgrupach wykorzystano test chi-kwadrat. Istotność statystyczną ustalono na poziomie p<0,05. Analizę statystyczną przeprowadzono przy użyciu programu Statistica 13.0 PL (Tibco, Kraków, Polska).
Wyniki
W przeprowadzonym badaniu wśród wszystkich pacjentek dokonano oceny zmiennych antropometrycznych: masa ciała, wzrost, wskaźnik BMI, obwód zmierzony w talii, obwód bioder, wskaźnik WHR. Nie stwierdzono istotnych różnic pomiędzy grupami w zakresie tych analizowanych zmiennych.
W następnym kroku analizowano zmienne biochemiczne w tym oceniono zawartość wybranych hormonów. Najwyższą wartość 17-OH-P zmierzono u pacjentek z fenotypem A i istotnie różniła się ona od fenotypu C. Najniższy poziom wolnego testosteronu stwierdzono w fenotypie D i istotnie różnił się od jego wartości u kobiet z fenotypem A i B. Takie same wyniki uzyskano dla całkowitego testosteronu. W przypadku poziomów androstendionu istotne różnice stwierdzono między fenotypem C i D. W odniesieniu do DHEAS najniższe wartości stwierdzono w fenotypie D, a istotną różnicę stwierdzono względem fenotypów A, B i C. Najniższe poziomy AMH stwierdzono w fenotypie B i istotnie różniły się one od fenotypów A i D. Najniższe poziomy insuliny odnotowano w fenotypie C i istotnie różniły się one od poziomów insuliny w fenotypie B. Wielokrotne porównania poziomów glukozy i HOMA-IR nie różniły się istotnie. Jest to sprzeczne z testem Kruskala-Wallisa, jednak test Dunna ma inne cechy. Szczegółowe wyniki z uwzględnieniem podziału na fenotypy PCOS pacjentek uwzględnionych w badaniu prezentuje tabela 1 i 2.
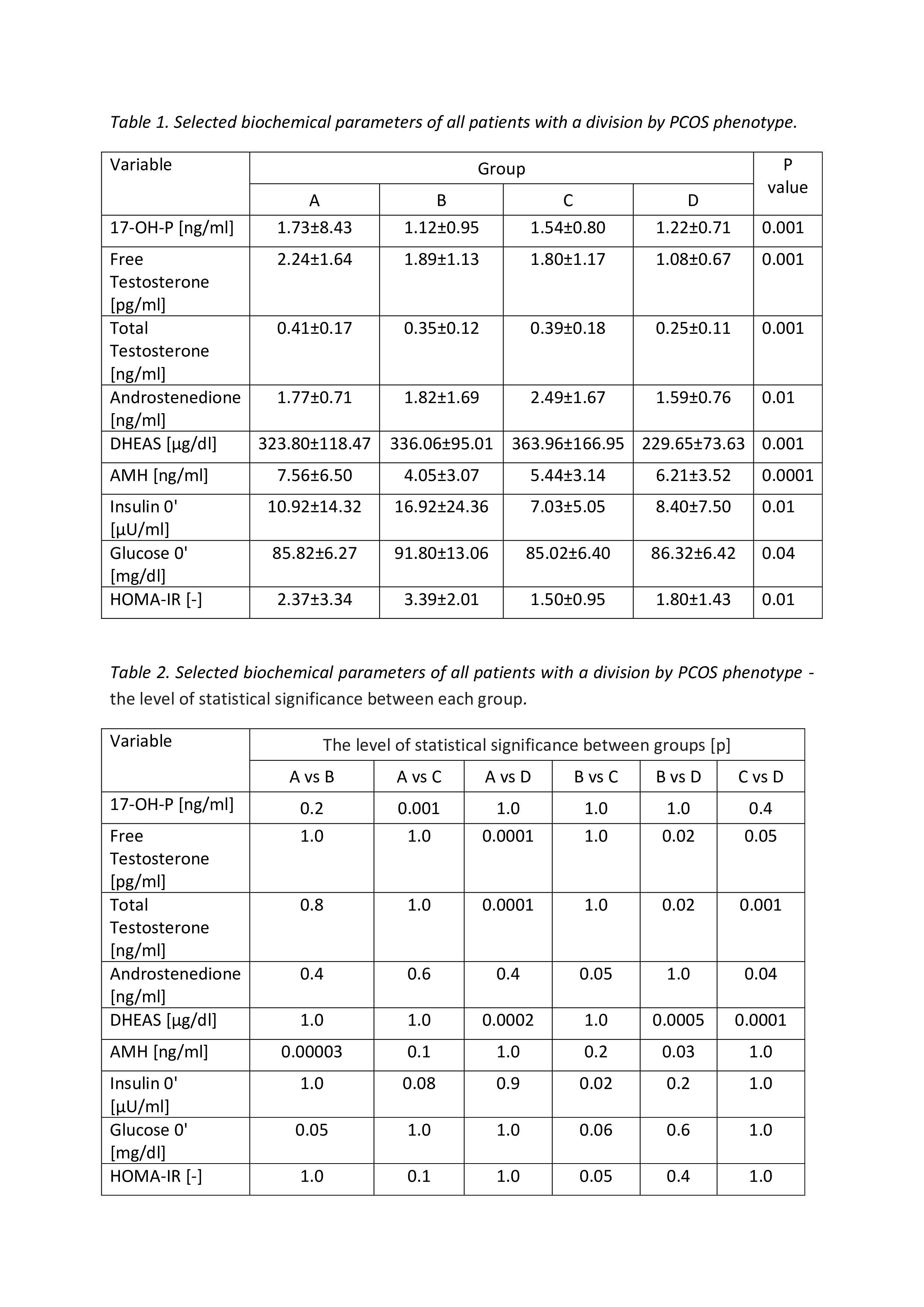
W przeprowadzonym badaniu dokonano analizy wyników w zakresie mediany wartości wskaźnika FIB-4. Znamiennie istotną różnicę w zakresie FIB-4 odnotowano jedynie pomiędzy fenotypem A i B (p=0.01). Mediana wskaźnika FIB-4 wśród pacjentów z fenotypem B wynosiła Me: -0,51; IQR: 0,22. Mediana wskaźnika FIB-4 wśród pacjentów z fenotypem A wynosiła Me: -0,41; IQR: 0,18. Post hoc (test Dunna) wartości p kontrolowane dla wielokrotnych porównań. Szczegółowe wyniki w zakresie mediany wskaźnika FIB-4 przedstawiono na rycinie 1.
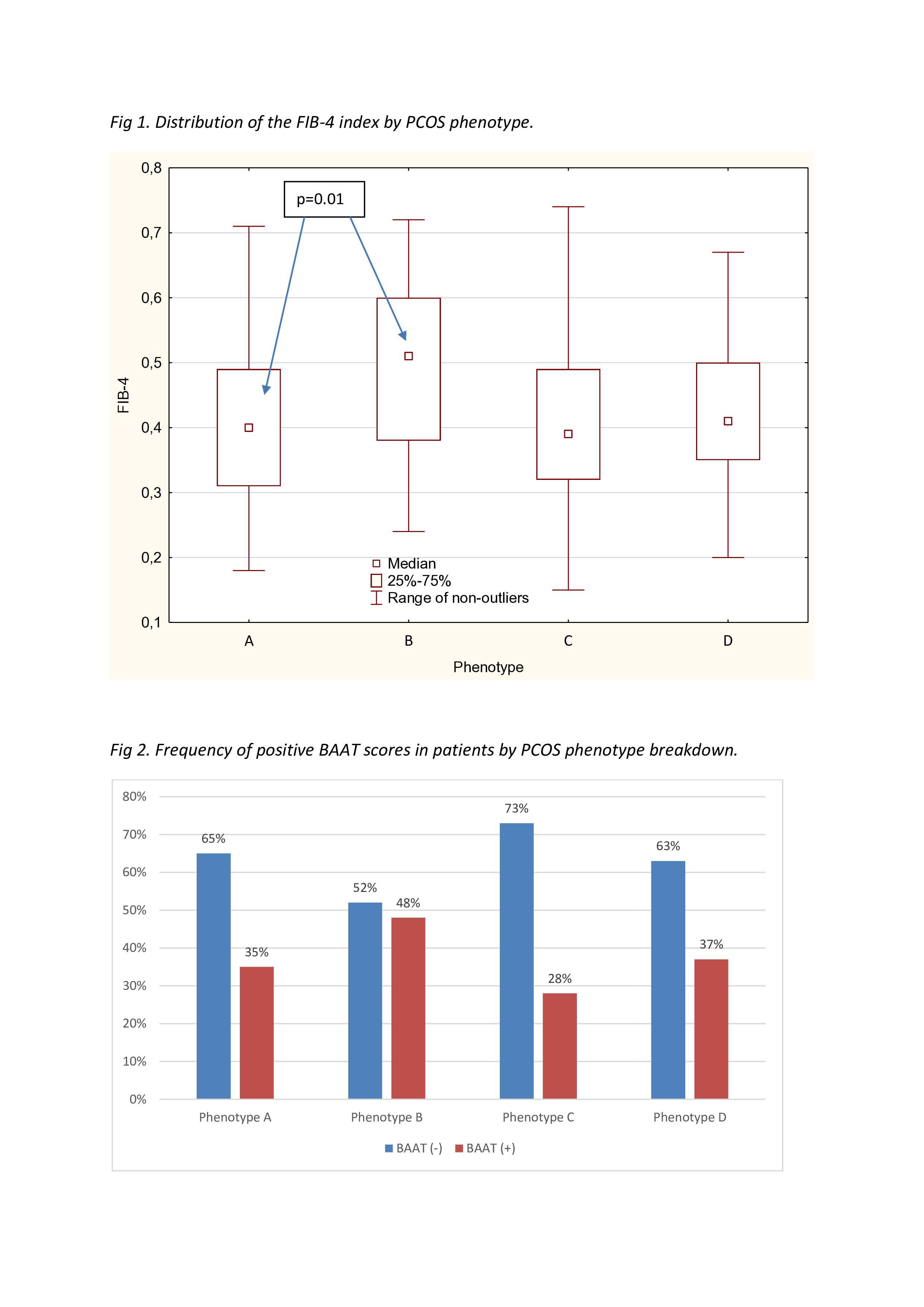
W przeprowadzonym badaniu dokonano oceny pomiędzy występowaniem zwłóknienia według skali BAAT i niewystępowaniem zwłóknienia według skali BAAT u badanych pacjentek z uwzględnieniem podziału na fenotyp PCOS. Wyniki tych grup są podobne, różnica ta okazała się statystycznie nieznamienna (p=0.3). Szczegółowe wyniki prezentuje ryc. 2.
Dyskusja
Biorąc pod uwagę bezpieczeństwo pacjentów wciąż poszukuje się nowych, nieinwazyjnych metod diagnostycznych, które mogłyby być w praktyce wykorzystywane celem lepszego wykrywania niektórych znanych jednostek chorobowych. Takie postępowanie wymusza na nas zwiększające się występowanie między innymi chorób wątroby, a co za tym idzie rosnące koszty opieki zdrowotnej [12]. Badania wykazują, że najczęstszym schorzeniem wątroby jest stłuszczeniowa choroba wątroby związana z zaburzeniami metabolicznymi, która wiążę się z kolei ze zwiększonym ryzykiem śmiertelności z przyczyn sercowo-naczyniowych, nowotworów złośliwych i chorób wątroby [13]. W metaanalizie do której włączono 32 badania, w skład których wchodziło łącznie 145131 pacjentek wykazano istotny związek pomiędzy PCOS, a zwiększonym ryzykiem MASLD [4]. Co więcej, Autorzy wspomnianej metaanalizy podkreślają, że wczesne właściwe wykrycie tej choroby wątroby jest niezbędne dla pacjentek z PCOS. Te dwie choroby mają wiele wspólnych czynników ryzyka, w tym insulinooporność, hiperandrogenemię (zwiększone stężenie testosteronu całkowitego i wolnego) i przewlekłe zapalenie o niskim stopniu nasilenia [14]. Warto więc się zastanowić, co zrobić, aby jak najwcześniej wykryć MASLD u pacjentek z PCOS.
W metaanalizie obejmującej 13046 pacjentów, która porównywała skuteczność nieinwazyjnych metod w rozpoznawaniu stopnia zaawansowania zwłóknienia wątroby, wykazano największą skuteczność wskaźników NAFLD fibrosis score i FIB-4 [15]. Stosując FIB-4 warto zwrócić uwagę na różne punkty odcięcia w zależności od wieku pacjentów, zgodnie z wieloośrodkowym badaniem japońskich naukowców FIB-4 w najmłodszej grupie wiekowej tj. poniżej 49 roku życia zaproponowano punkty odcięcia od 1,05 do 1,2, które zwiększają się wraz z wiekiem [16]. W innych badaniach wykazano również, że poza oceną zwłóknienia wątroby, kalkulator FIB-4 jest istotnym czynnikiem predykcyjnym śmiertelności u chorych z MASLD z przyczyn sercowo-naczyniowych, nowotworów innych niż wątroba, chorób wątroby i cukrzycy [17-20]. W dotychczas opisanych badaniach dowiedziono, że wskaźnik FIB-4 był wyższy u pacjentek z PCOS w porównaniu do grupy kontrolnej, niemniej jednak z uwagi na młody wiek i małą liczbę chorób współistniejących uzyskano stosunkowo niskie wyniki i uzasadnione są dalsze badania mające na celu walidację wskaźników uszkodzenia wątroby [10]. Z uwagi na heterogenność PCOS w naszym badaniu podzieliliśmy pacjentki na fenotypy zgodnie z przyjętą klasyfikacją [2]. Przeprowadzona w badaniu analiza statystyczna wykazała najwyższą medianę wskaźnika FIB-4 w zakresie fenotypu B, jednak należy zwrócić uwagę na to, że prawdopodobieństwo włóknienia wątroby wg FIB-4 jest w naszym badaniu niskie bez względu na fenotyp PCOS. W tym miejscu warto zwrócić uwagę, że w przeprowadzonym przez nas badaniu oceniano parametry antropometryczne: wskaźnik masy ciała (BMI) i stosunek talia-biodra (WHR) u pacjentek z PCOS podzielonych na fenotypy, nie wykazując istotności statystycznej, co nie przemawia za wpływem ww. parametrów na zwiększony FIB-4. Potwierdzać to mogą wcześniej przeprowadzone badania, w których zwłóknienie wątroby zdefiniowane przez FIB-4 było niezależnie powiązane z ryzykiem wystąpienia zdarzeń sercowo-naczyniowych w MASLD nawet po uwzględnieniu innych czynników ryzyka takich jak wiek, płeć, otyłość, nadciśnienie tętnicze, cukrzyca [21-23].
W naszym badaniu parametrem laboratoryjnym, który jest statystycznie istotnie zwiększony w fenotypie B jest insulina. Warto więc przedyskutować, czy HOMA-IR mógłby służyć jako wskaźnik do screeningu w kierunku chorób wątroby u pacjentek z PCOS. Badania pokazują, że wartości HOMA-IR ≥2,0 lub 2,5 korelują ze zwiększonym ryzykiem MASLD [24]. Co więcej dotychczas przeprowadzone badania pod kątem potencjalnych wczesnych wskaźników wykrywania MASLD wykazały, że dzięki HOMA-IR (≥2,5) mamy większą zdolność do rozróżniania MASLD i zwłóknienia wątroby u pacjentów z przewlekłymi chorobami wątroby z obecnością lub bez stłuszczenia i jednocześnie przy braku nadmiernego spożycia alkoholu [25]. Dla kontrastu, w innych badaniach stwierdzono zwiększone ryzyko występowania MASLD u pacjentek z hiperandrogennymi fenotypami PCOS, niezależnie od insulinooporności [26].
Biorąc pod uwagę powyższe wątpliwości, w naszym badaniu uwzględniliśmy również wskaźnik do oceny w kierunku MASLD, w skład którego poza oceną aktywności enzymu wątrobowego i wieku wchodzi zarówno parametr określający masę ciała (BMI) oraz stężenie triglicerydów (TG). W tym celu skorzystaliśmy z kalkulatora BAAT, w którym 1 punkt otrzymuje się za BMI ≥28,0 kg/m2, wiek ≥50 lat, ALT ≥2 razy powyżej górnej granicy normy, stężenie TG ≥1,7 mmol/l (=≥150 mg/dl) [9]. W koreańskim badaniu obejmującym 3634 pacjentów, udowodniono istotną korelację pomiędzy MASLD, a wskaźnikiem BAAT [7]. Co więcej, w badaniu, w którym wzięło udział 314 pacjentek z PCOS, wykazano wyższe wyniki dla wskaźnika BAAT w porównaniu do grupy kontrolnej [10]. Oba te niezależne badania mogą sugerować przydatność wskaźnika BAAT do screeningu w kierunku chorób wątroby u pacjentek cierpiących na PCOS.
Wskaźniki FIB-4 i BAAT zostały wykorzystane wspólnie w wielu publikacjach dotyczących wpływu zwłóknienia wątroby na wiele jednostek chorobowych. W jednym z nich oceniano wartość predykcyjną wspomnianych wyżej wskaźników zwłóknienia wątroby dla ryzyka chorób sercowo-naczyniowych w populacji z nadciśnieniem tętniczym. Badanie to ze średnim czasem obserwacji trwającym 4,66 roku wykazało powiązanie m.in. FIB-4 i BAAT z chorobami układu krążenia w tej populacji, a na dodatek zasugerowało, że wymienione wskaźniki zwłóknienia wątroby mogą być nowym narzędziem do identyfikacji pacjentów z wysokim ryzykiem pierwotnych chorób sercowo-naczyniowych w populacji z nadciśnieniem tętniczym [27]. W innym badaniu z wykorzystaniem FIB-4 i BAAT próbowano wyjaśnić związek pomiędzy kalkulatorami zwłóknienia wątroby, a przewlekłą chorobą nerek (PChN). Zaobserwowano, że FIB-4 i BAAT były wyższe w populacji osób z PChN w porównaniu z populacjami bez PChN [28]. Ci sami Autorzy, w kolejnym badaniu ocenili wartości wskaźników zwłóknienia wątroby dla ryzyka wystąpienia udaru mózgu, w którym stwierdzili, że zwiększone FIB-4 i BAAT było powiązane ze zwiększonym prawdopodobieństwem udaru. Co więcej badanie to sugeruje, że wymienione wskaźniki zwłóknienia wątroby można wykorzystać jako narzędzie do oceny ryzyka przewidywania udaru [29]. Zacytowane badania pokazują, że zwłóknienie wątroby, które jak dowiedziono wcześniej częściej występuje u pacjentek z PCOS [10], może wiązać się z wieloma powikłaniami zwiększającymi śmiertelność.
Wnioski
Podsumowując, prawdopodobieństwo włóknienia wątroby u badanych pacjentek z PCOS na podstawie wskaźnika FIB-4 jest niskie, co najpewniej wynika z młodego wieku badanych. Wyższe wyniki wskaźnika FIB-4 uzyskaliśmy w grupie pacjentek z fenotypem B względem grupy z fenotypem A, a grupa z fenotypem B była podobna do grup z fenotypem C i D. Ponadto na podstawie naszych wyników wykazaliśmy niższy poziom insuliny w fenotypie C w porównaniu do grupy z fenotypem B. Wynik wskaźnika BAAT okazał się nieistotny statystycznie u badanych pacjentek z uwzględnieniem podziału na fenotyp PCOS. Biorąc pod uwagę powyższe, konieczne są dalsze badania oceniające przydatność nieinwazyjnych metod diagnostyki MASLD, szczególnie u pacjentów w młodszych grupach wiekowych, w tym z PCOS.
Piśmiennictwo
1. Bozdag G, Mumusoglu S, Zengin D, Karabulut E, Yildiz BO. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod. 2016;31(12):2841-2855. doi:10.1093/humrep/dew218, indexed in Pubmed: 27664216
2. Azziz R. Polycystic Ovary Syndrome. Obstet Gynecol. 2018;132(2):321-336. doi:10.1097/AOG.0000000000002698, indexed in Pubmed: 29995717
3. Rinella ME, Lazarus JV, Ratziu V, et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. J Hepatol. 2023;79(6):1542-1556. doi:10.1016/j.jhep.2023.06.003, indexed in Pubmed: 37364790
4. Yao K, Zheng H, Peng H. Association between polycystic ovary syndrome and risk of non-alcoholic fatty liver disease: a meta-analysis. Endokrynol Pol. 2023;74(5):520-527. doi:10.5603/ep.93291, indexed in Pubmed: 37779372
5. Chakraborty S, Ganie MA, Masoodi I, et al. Fibroscan as a non-invasive predictor of hepatic steatosis in women with polycystic ovary syndrome. Indian J Med Res. 2020;151(4):333-341. doi:10.4103/ijmr.IJMR_610_18, indexed in Pubmed: 32461397
6. Xu XL, Jiang LS, Wu CS, et al. The role of fibrosis index FIB-4 in predicting liver fibrosis stage and clinical prognosis: A diagnostic or screening tool?. J Formos Med Assoc. 2022;121(2):454-466. doi:10.1016/j.jfma.2021.07.013, indexed in Pubmed: 34325952
7. Jeong S, Kim K, Chang J, et al. Development of a simple nonalcoholic fatty liver disease scoring system indicative of metabolic risks and insulin resistance. Ann Transl Med. 2020;8(21):1414. doi:10.21037/atm-20-2951, indexed in Pubmed: 33313159
8. Sterling RK, Lissen E, Clumeck N, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology. 2006;43(6):1317-1325. doi:10.1002/hep.21178, indexed in Pubmed: 16729309
9. Ratziu V, Giral P, Charlotte F, et al. Liver fibrosis in overweight patients. Gastroenterology. 2000;118(6):1117-1123. doi:10.1016/s0016-5085(00)70364-7, indexed in Pubmed: 10833486
10. Polyzos SA, Goulis DG, Kountouras J, et al. Non-alcoholic fatty liver disease in women with polycystic ovary syndrome: assessment of non-invasive indices predicting hepatic steatosis and fibrosis. Hormones (Athens). 2014;13(4):519-531. doi:10.14310/horm.2002.1493, indexed in Pubmed: 25402369
11. Teede HJ, Tay CT, Laven JJE, et al. Recommendations from the 2023 international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Eur J Endocrinol. 2023;189(2):G43-G64. doi:10.1093/ejendo/lvad096, indexed in Pubmed: 37580861
12. Perumpail BJ, Khan MA, Yoo ER, Cholankeril G, Kim D, Ahmed A. Clinical epidemiology and disease burden of nonalcoholic fatty liver disease. World J Gastroenterol. 2017;23(47):8263-8276. doi:10.3748/wjg.v23.i47.8263, indexed in Pubmed: 29307986
13. Rinella ME, Sanyal AJ. Management of NAFLD: a stage-based approach. Nat Rev Gastroenterol Hepatol. 2016;13(4):196-205. doi:10.1038/nrgastro.2016.3, indexed in Pubmed: 26907882
14. Chen MJ, Ho HN. Hepatic manifestations of women with polycystic ovary syndrome. Best Pract Res Clin Obstet Gynaecol. 2016;37:119-128. doi:10.1016/j.bpobgyn.2016.03.003, indexed in Pubmed: 27107966
15. Xiao G, Zhu S, Xiao X, Yan L, Yang J, Wu G. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fibrosis in patients with nonalcoholic fatty liver disease: A meta-analysis. Hepatology. 2017;66(5):1486-1501. doi:10.1002/hep.29302, indexed in Pubmed: 28586172
16. Ishiba H, Sumida Y, Tanaka S, et al. The novel cutoff points for the FIB4 index categorized by age increase the diagnostic accuracy in NAFLD: a multi-center study [published correction appears in J Gastroenterol. 2018 Nov;53(11):1225. doi: 10.1007/s00535-018-1478-7]. J Gastroenterol. 2018;53(11):1216-1224. doi:10.1007/s00535-018-1474-y, indexed in Pubmed: 29744597
17. Kim D, Kim WR, Kim HJ, Therneau TM. Association between noninvasive fibrosis markers and mortality among adults with nonalcoholic fatty liver disease in the United States. Hepatology. 2013;57(4):1357-1365. doi:10.1002/hep.26156, indexed in Pubmed: 23175136
18. Hagström H, Nasr P, Ekstedt M, et al. Fibrosis stage but not NASH predicts mortality and time to development of severe liver disease in biopsy-proven NAFLD. J Hepatol. 2017;67(6):1265-1273. doi:10.1016/j.jhep.2017.07.027, indexed in Pubmed: 28803953
19. Hagström H, Nasr P, Ekstedt M, Stål P, Hultcrantz R, Kechagias S. Accuracy of Noninvasive Scoring Systems in Assessing Risk of Death and Liver-Related Endpoints in Patients With Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2019;17(6):1148-1156.e4. doi:10.1016/j.cgh.2018.11.030, indexed in Pubmed: 30471458
20. Angulo P, Bugianesi E, Bjornsson ES, et al. Simple noninvasive systems predict long-term outcomes of patients with nonalcoholic fatty liver disease. Gastroenterology. 2013;145(4):782-9.e4. doi:10.1053/j.gastro.2013.06.057, indexed in Pubmed: 23860502
21. Iwasaki Y, Shiina K, Matsumoto C, et al. Correlation of the Fatty Liver Index with the Pathophysiological Abnormalities Associated with Cardiovascular Risk Markers in Japanese Men without any History of Cardiovascular Disease: Comparison with the Fibrosis-4 Score. J Atheroscler Thromb. 2021;28(5):524-534. doi:10.5551/jat.56945, indexed in Pubmed: 32713932
22. Han E, Lee YH, Kim YD, et al. Nonalcoholic Fatty Liver Disease and Sarcopenia Are Independently Associated With Cardiovascular Risk. Am J Gastroenterol. 2020;115(4):584-595. doi:10.14309/ajg.0000000000000572, indexed in Pubmed: 32141917
23. Baratta F, Pastori D, Angelico F, et al. Nonalcoholic Fatty Liver Disease and Fibrosis Associated With Increased Risk of Cardiovascular Events in a Prospective Study. Clin Gastroenterol Hepatol. 2020;18(10):2324-2331.e4. doi:10.1016/j.cgh.2019.12.026, indexed in Pubmed: 31887443
24. Salgado AL, Carvalho Ld, Oliveira AC, Santos VN, Vieira JG, Parise ER. Insulin resistance index (HOMA-IR) in the differentiation of patients with non-alcoholic fatty liver disease and healthy individuals. Arq Gastroenterol. 2010;47(2):165-169. doi:10.1590/s0004-28032010000200009, indexed in Pubmed: 20721461
25. Xue Y, Xu J, Li M, Gao Y. Potential screening indicators for early diagnosis of NAFLD/MAFLD and liver fibrosis: Triglyceride glucose index-related parameters. Front Endocrinol (Lausanne). 2022;13:951689. Published 2022 Sep 2. doi:10.3389/fendo.2022.951689, indexed in Pubmed: 36120429
26. Jones H, Sprung VS, Pugh CJ, et al. Polycystic ovary syndrome with hyperandrogenism is characterized by an increased risk of hepatic steatosis compared to nonhyperandrogenic PCOS phenotypes and healthy controls, independent of obesity and insulin resistance. J Clin Endocrinol Metab. 2012;97(10):3709-3716. doi:10.1210/jc.2012-1382, indexed in Pubmed: 22837189
27. Xiong S, Yin S, Deng W, et al. Predictive value of liver fibrosis scores in cardiovascular diseases among hypertensive population. J Hypertens. 2023;41(5):741-750. doi:10.1097/HJH.0000000000003394, indexed in Pubmed: 36883472
28. Xiong S, Wang P, Yin S, et al. The association between liver fibrosis scores and chronic kidney disease. Front Med (Lausanne). 2023;10:1046825. Published 2023 Jan 30. doi:10.3389/fmed.2023.1046825, indexed in Pubmed: 36793875
29. Xiong S, Yin S, Deng W, et al. Impact of liver fibrosis score on the incidence of stroke: A cohort study. Liver Int. 2022;42(10):2175-2185. doi:10.1111/liv.15359, indexed in Pubmed: 35789194
Pierowtna wersja publikacji (w języku angielskim) na łamach Endokrynologii Polskiej »